Transfert de Chaleur dans un Système Fermé
Comprendre le Transfert de Chaleur dans un Système Fermé
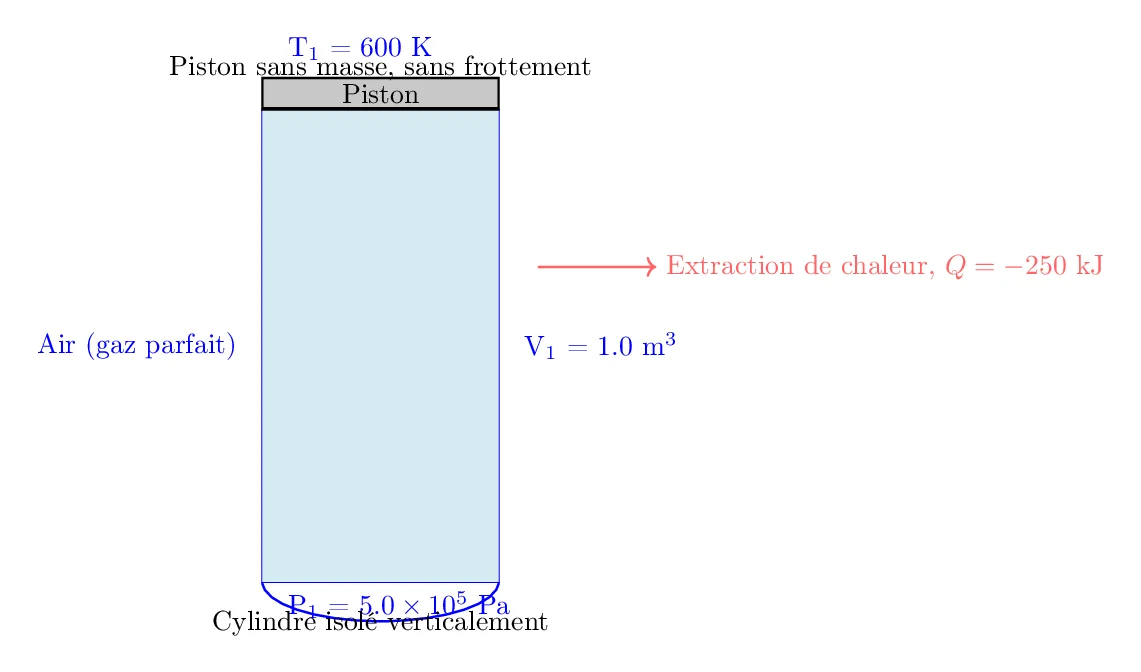
Un ingénieur en thermodynamique étudie le transfert de chaleur dans un système clos contenant de l’air à haute température. Le système est un cylindre isolé verticalement contenant de l’air qui peut être considéré comme un gaz parfait.
Un piston sans masse et sans frottement scelle le haut du cylindre et peut se déplacer librement. Initialement, le cylindre est chauffé pour que l’air atteigne une certaine température et pression, puis une certaine quantité de chaleur est extraite du système, causant des changements de pression, volume et température.
Données:
- Volume initial (\(V_1\)): \(1.0 \, \text{m}^3\)
- Pression initiale (\(P_1\)): \(5.0 \times 10^5 \, \text{Pa}\)
- Température initiale (\(T_1\)): \(600 \, \text{K}\)
- Chaleur extraite (\(Q\)): \(- 250 \, \text{kJ}\) (Notez que Q est négative car elle est retirée du système)
- Capacité calorifique à pression constante du gaz (\(C_p\)): \(29 \, \text{J/mol K}\)
- Constante des gaz parfaits (\(R\)): \(8.31 \, \text{J/mol K}\)
Questions:
1. Calculer le nombre de moles d’air dans le cylindre initialement.
2. Déterminer la température finale de l’air après l’extraction de la chaleur.
3. Calculer la pression finale dans le cylindre en supposant que le volume reste constant.
Correction : Transfert de Chaleur dans un Système Fermé
1. Calcul du nombre de moles d’air initialement
On utilise l’équation d’état des gaz parfaits :
\[ P_1 V_1 = n R T_1 \]
On peut isoler \(n\) :
\[ n = \frac{P_1 V_1}{R T_1} \]
Données et Calcul :
\[ n = \frac{5.0 \times 10^5\ \text{Pa} \times 1.0\ \text{m}^3}{8.31\ \text{J/mol·K} \times 600\ \text{K}} \] \[ n = \frac{500\,000}{4986} \] \[ n \approx 100.3\ \text{mol} \]
Résultat :
Le cylindre contient environ 100.3 moles d’air initialement.
2. Détermination de la température finale après extraction de la chaleur
Pour un processus à pression constante, la variation de chaleur est donnée par :
\[ Q = n\,C_p\,\Delta T \quad \text{où} \quad \Delta T = T_f – T_1 \]
On peut isoler \(T_f\) :
\[ T_f = T_1 + \frac{Q}{n\,C_p} \]
Données et Calcul :
Substituons les valeurs :
\[ T_f = 600\ \text{K} + \frac{-250\,000\ \text{J}}{100.3\ \text{mol} \times 29\ \text{J/mol·K}} \]
Calcul du dénominateur :
\[ 100.3 \times 29 \approx 2908.7\ \text{J/K} \]
Calcul de la variation de température :
\[ \frac{-250\,000}{2908.7} \approx -85.96\ \text{K} \]
Ainsi :
\[ T_f \approx 600\ \text{K} – 86\ \text{K} \] \[ T_f \approx 514\ \text{K} \]
Résultat :
La température finale de l’air est d’environ 514 K.
3. Calcul de la pression finale dans le cylindre en supposant que le volume reste constant
Si le volume reste constant (\(V_f = V_1\)) et que le nombre de moles est constant, l’équation d’état pour un gaz parfait (relation de Gay-Lussac) s’écrit :
\[ \frac{P_1}{T_1} = \frac{P_f}{T_f} \quad \Rightarrow \quad P_f = P_1 \times \frac{T_f}{T_1} \]
Formule :
\[ P_f = P_1 \times \frac{T_f}{T_1} \]
Données et Calcul :
Substituons les valeurs :
\[ P_f = 5.0 \times 10^5\ \text{Pa} \times \frac{514\ \text{K}}{600\ \text{K}} \]
Calcul du rapport :
\[ \frac{514}{600} \approx 0.8567 \]
Donc :
\[ P_f \approx 5.0 \times 10^5\ \text{Pa} \times 0.8567 \] \[ P_f \approx 428350\ \text{Pa} \]
Résultat :
La pression finale dans le cylindre est d’environ \(4.28 \times 10^5\, \text{Pa}\).
Transfert de Chaleur dans un Système Fermé
D’autres exercices de thermodynamique:













0 commentaires